虫媒病毒在全世界范围内持续引发疫情,对人类生命健康造成较大影响,但特异性防治手段却极其有限。发热伴血小板减少综合征病毒(Severe Fever with Thrombocytopenia Syndrome Virus ,SFTSV)是近年来在亚洲国家持续流行的新型布尼亚病毒,其经蜱虫叮咬实现跨种传播,在蜱虫活动季节如5-8月份引发感染高峰。人感染后的典型症状为持续性发热、胃肠道不适、白细胞及血小板数目显著下降,严重者会出现多器官衰竭甚至死亡。近年来,SFTSV由山林、农村地区向城郊传播,在亚洲以外的国家如希腊、阿拉伯和美国等地也出现类似病例,其总体流行区域呈现扩大化。然而,针对SFTSV感染临床仅以支持性治疗为主,目前尚无获批的特异性药物或疫苗。中国科学院武汉病毒研究所肖庚富/潘晓彦团队和珠海丽凡达生物技术有限公司共同研制了一款SFTSV全长Glycoprotein(GP) mRNA疫苗,并对该疫苗的保护机制和预防效果进行了深入研究和评价。相关工作近期在国际专业病毒学期刊Journal of Virology(JVI)在线发表。

SFTSV基因组由L,M和S片段组成,其中M片段编码囊膜糖蛋白前体GP,GP在内质网中被加工成Gn/Gc异二聚体(在感染新的宿主细胞时,Gn负责与受体结合,Gc则介导膜融合),该二聚体在高尔基体中进一步形成非均质的五聚体和六聚体,并包裹病毒遗传物质组装成完整病毒粒子,病毒粒子通过囊泡运送至胞膜并释放。因此,SFTSV GP主要是在胞内表达成熟,且在胞内完成组装,促进病毒粒子胞间传递。鉴于成熟SFTSV囊膜蛋白结构的复杂性,体外重组表达具有天然构象的囊膜蛋白难以实现,因此过往研究中基于Gn/Gc制备的重组蛋白亚单位疫苗难以提供有效体内保护。本研究正是基于Gn/Gc的功能特性和GP的表达特性,试图利用mRNA疫苗的原位表达优势再现GP的天然表达过程,利用未经改造的全长GP mRNA疫苗,诱导针对GP的真实免疫反应进而为SFTSV感染提供保护作用,在疫苗设计上做减法。
经过体外哺乳动物细胞表达验证,全长GP mRNA疫苗可在胞内有效表达。免疫原性测试结果表明,该疫苗可在小鼠体内诱导产生高滴度针对SFTSV Gn和Gc的特异性结合抗体,并对SFTSV活病毒产生高效中和作用;特别值得注意的是,该疫苗显著诱导T细胞免疫反应,表现为Th 1偏向型细胞免疫应答,并促进记忆性效应T细胞(memory effector T cells,Tem)的生成。攻毒保护结果表明,1 μg该疫苗即可为致死剂量攻毒的A129小鼠提供100%保护,0.1 μg亦可提供90%保护,并有效避免病毒感染引发的组织损伤,该结果在腹腔攻毒和肌肉攻毒模型中均得到了验证。另外,该疫苗诱导的免疫反应和保护作用在5个月内未见明显减弱,预示其潜在的长效保护作用。
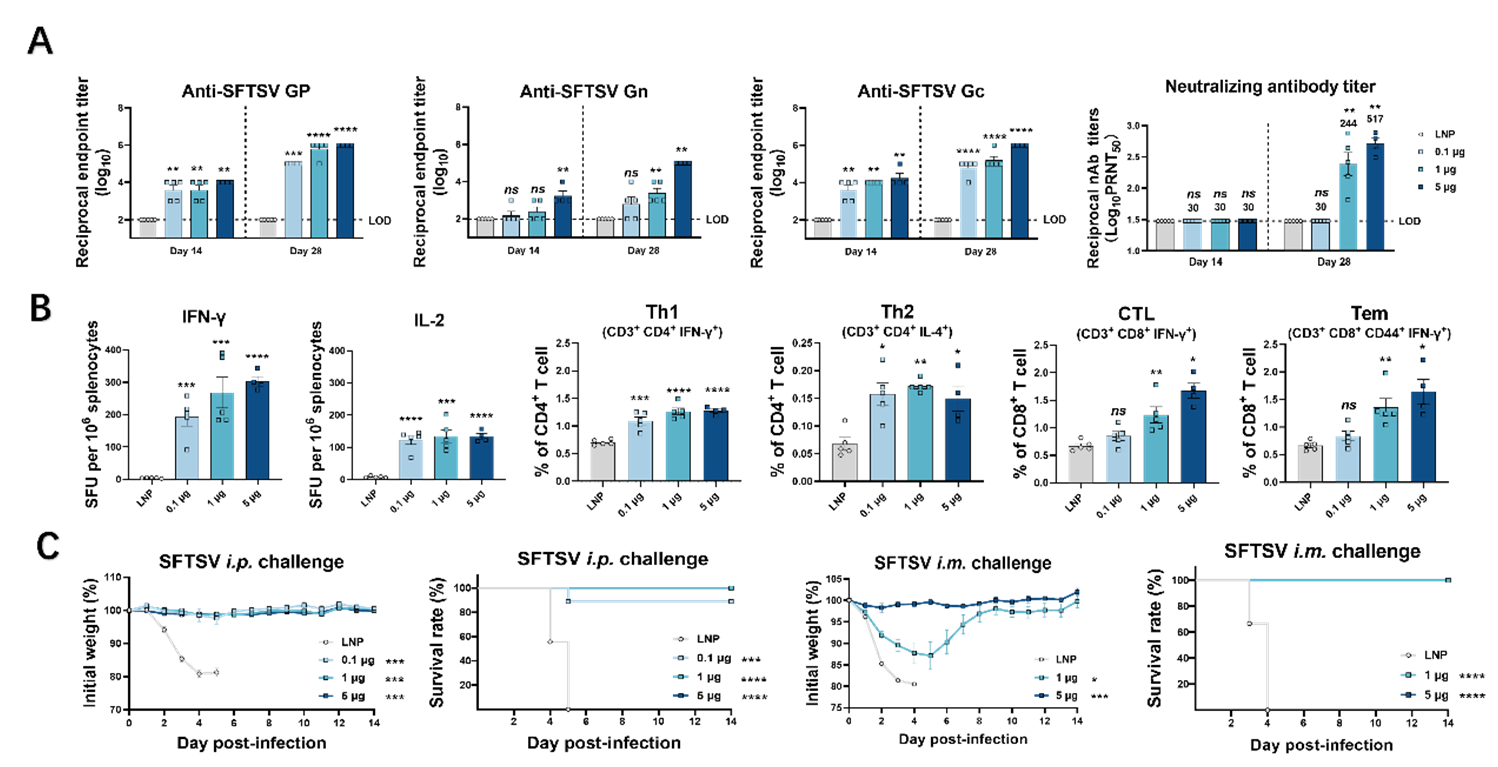
(A-B:BALB/c小鼠经过不同剂量GP mRNA疫苗接种后,体内体液免疫和细胞免疫应答情况;C:A129小鼠接种不同剂量疫苗后,经腹腔和肌肉途径实施致死剂量SFTSV攻毒,其体重及存活情况)
重要的是,该全长GP mRNA疫苗对SFTSV同属病原哈特兰病毒(Heartland Virus,HRTV)和具有潜在致病风险的古尔图病毒(Guertu Virus,GTV)亦具有完全交叉保护作用,且该保护作用是在无交叉结合或中和抗体的情况下发生的。进一步研究发现,来源于SFTSV GP的保守肽段可能诱导T细胞免疫进而介导该保护作用的发生。本研究不仅鉴定了班达病毒属(Bandavirus)病原的潜在交叉保护T细胞表位,同时也鉴定了一系列SFTSV GP来源的白纤病毒科(Phenuiviridae)潜在T细胞表位,提示SFTSV GP全长提供广谱表位和广谱保护作用的可能性。
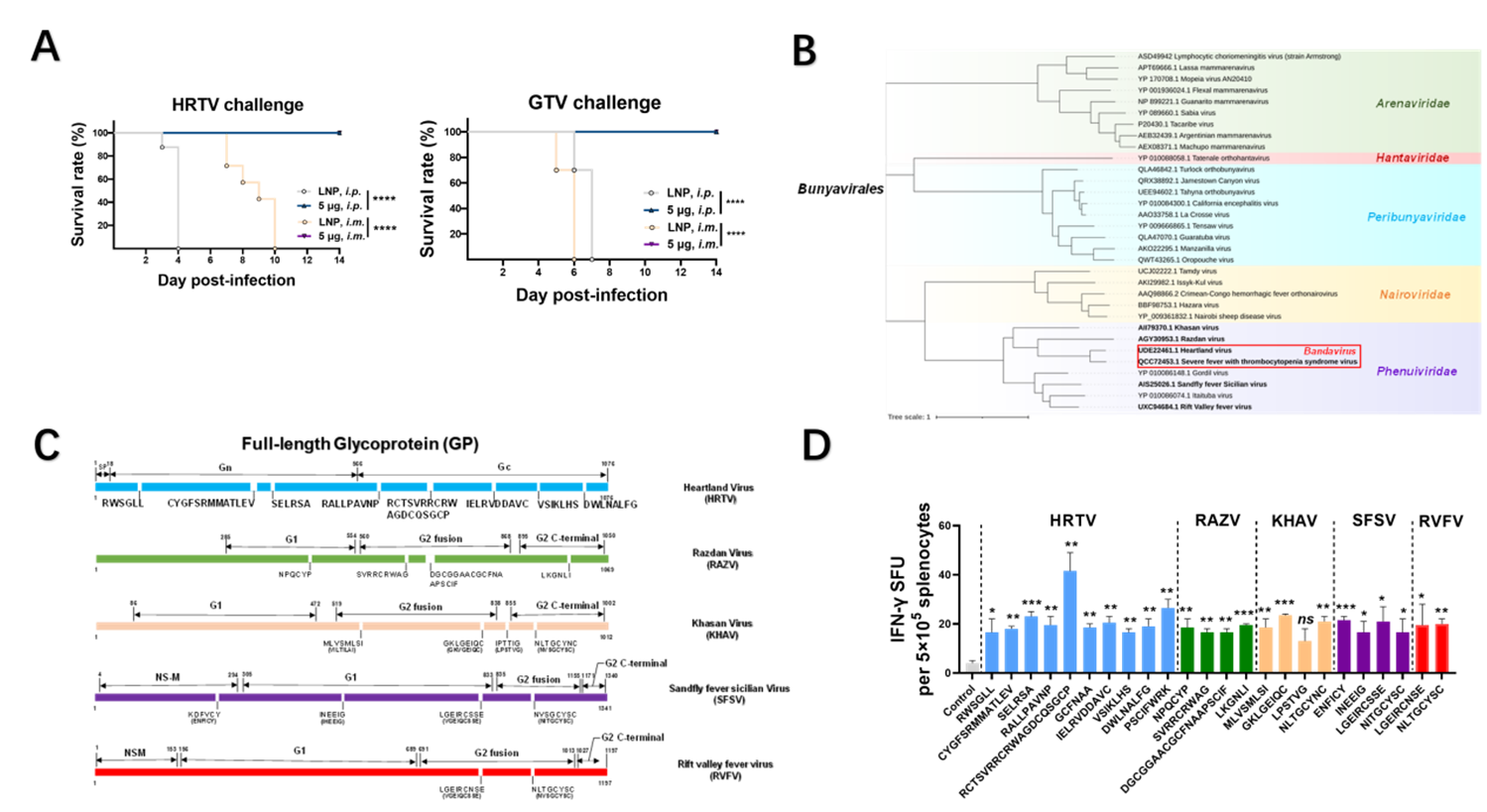
(A:AG129或A129小鼠接种疫苗后,经腹腔和肌肉途径实施致死剂量HRTV或GTV攻毒,小鼠存活率情况;B:班达病毒属和白纤病毒科病原在布尼亚病毒目中的进化位置;C: 来源于SFTSV全长GP的保守表位分析;D: SFTSV GP的潜在T细胞保护性表位鉴定)
总之,该研究证明了基于全长SFTSV GP构建的mRNA疫苗对SFTSV感染的高效保护性,并证明了其对班达病毒的广谱交叉保护作用,提示其良好的应用前景。此外,该研究强调了T细胞免疫在介导班达病毒疫苗保护中的重要性,并提示基于保守T细胞表位设计广谱疫苗的潜在可行性。
该工作主要由武汉病毒所博士生陆嘉和珠海丽凡达生物技术有限公司刘隽博士共同完成,武汉病毒所潘晓彦青年研究员、肖庚富研究员及珠海丽凡达生物技术有限公司彭育才博士为本文通讯作者。武汉病毒所邓菲研究员和邓增钦研究员为该研究提供了宝贵的实验材料。该研究得到中国科学院青促会项目和武汉市知识创新专项的支持。
 附件下载:
附件下载:
科学研究