尼帕病毒(Nipah virus,NiV)是一种高度致病的人畜共患病毒,可引发严重的呼吸道疾病和致死性脑炎。自发现以来,尼帕病毒多次造成区域性暴发,被世界卫生组织列为具有大流行潜力的重点关注病原体。然而,目前针对尼帕病毒尚无获批的特异性抗病毒药物或疫苗,其复制与致病机制仍缺乏系统认识。
近日,中国科学院武汉病毒研究所关武祥团队在Protein & Cell杂志上发表了题为“NSUN2‑Mediated Epitranscriptomic and Ubiquitin Modulation of Nipah Virus Matrix Protein Reveals a Dual-Targeting Antiviral Strategy”的研究论文,该研究发现宿主RNA表观修饰酶NSUN2被纳入病毒复制调控网络,成为连接RNA甲基化与蛋白翻译后调控的关键枢纽。
感染发生后,病毒基质蛋白M与NSUN2直接相互作用,抑制其经由蛋白酶体途径的降解,显著提高细胞内NSUN2的稳定性和丰度,为后续病毒RNA修饰和蛋白调控过程奠定了分子基础。
在RNA层面,NSUN2通过其催化结构域在尼帕病毒RNA上催化5-甲基胞嘧啶(m⁵C)修饰。研究显示,病毒基因组RNA及多种病毒mRNA均存在显著m⁵C修饰,其中编码M蛋白的mRNA是重要靶标之一。m⁵C修饰显著增强病毒RNA的稳定性,使其在细胞内得以持续存在并高效翻译,从而维持关键病毒蛋白的充足表达。当NSUN2的甲基转移酶活性受到抑制或关键修饰位点被破坏时,病毒RNA更易发生降解,病毒复制能力随之下降。
除RNA修饰功能外,NSUN2还通过其非催化结构域参与病毒蛋白的翻译后调控。作为分子支架,NSUN2可招募泛素接头蛋白GNB2,并进一步促进E3泛素连接酶TRIM28与病毒M蛋白形成复合物,驱动其发生特定类型的泛素化修饰。这一泛素化过程对M蛋白的细胞内转运和功能发挥具有重要影响,从而在蛋白层面进一步支持病毒复制。
由此,NSUN2通过催化与非催化结构域的分工协作,在RNA甲基化与蛋白泛素化两个层面形成一套相互衔接的调控机制。一方面稳定病毒RNA,保障关键蛋白的持续表达;另一方面调控核心病毒蛋白的功能状态,共同推动尼帕病毒在宿主细胞内高效复制。
基于这一机制框架,靶向宿主依赖性通路的抗病毒潜力也得到了验证。蛋白酶体抑制剂carfilzomib以及抑制m⁵C修饰的小分子MY-1B均能有效抑制尼帕病毒复制,并在动物模型中降低病毒载量和组织损伤。联合干预两条通路时,可同时削弱病毒RNA稳定性和蛋白功能调控,产生更为显著的抗病毒效果。
总体而言,该研究揭示了尼帕病毒如何通过劫持单一宿主因子,在RNA表观修饰与蛋白泛素化两个层面协同调控病毒复制的分子机制。这一发现不仅深化了对高致病性RNA病毒宿主依赖性的理解,也为发展宿主导向型、联合靶向的抗病毒策略提供了新的思路和理论依据
。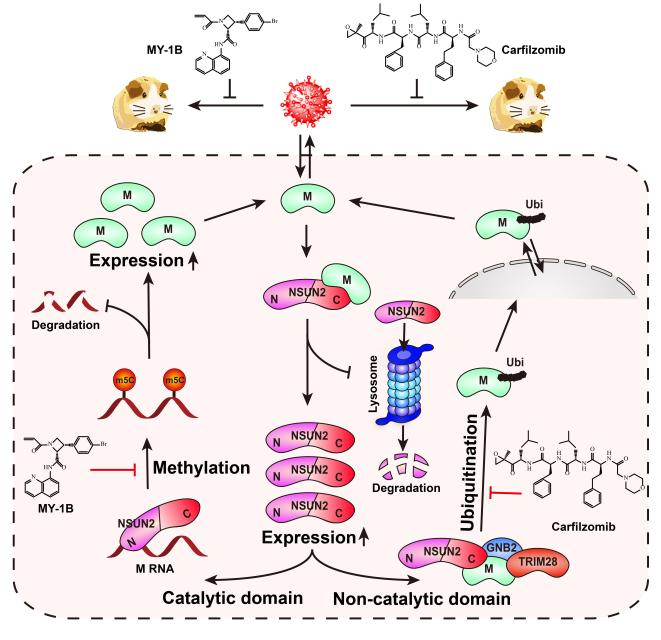
图注: 尼帕病毒通过劫持宿主NSUN2,借助m⁵C RNA甲基化和M蛋白泛素化增强病毒RNA稳定性与病毒颗粒装配,揭示了一种有效的双靶向抗病毒策略。
 附件下载:
附件下载:
科学研究