近日,中国科学院武汉病毒研究所/高致病性病毒与生物安全全国重点实验室邓增钦团队与王华林/宁云佳团队合作在发热伴血小板减少综合征病毒(SFTSV)核糖核蛋白复合物形成机制研究中取得进展。相关成果以“Structural insight into RNA encapsidation by the severe fever with thrombocytopenia syndrome virus nucleocapsid protein”为题发表在mBio期刊上。
SFTSV是一种蜱传高致病性布尼亚病毒,可引起高热、血小板减少及多器官功能衰竭,病死率最高可达30%,目前在东亚及东南亚多国流行。其主要传播媒介长角血蜱的跨洲扩散进一步加剧了该病毒的全球公共卫生威胁。目前尚无针对该病毒的获批疫苗或特异性抗病毒药物。在病毒生命周期中,核衣壳蛋白(NP)通过结合并封装病毒基因组RNA形成核糖核蛋白复合物(RNP),以保护病毒基因组并参与病毒基因组的复制和转录。阐明RNP的形成机制对于理解病毒复制策略及抗病毒药物研发具有重要意义。
该研究发现,重组表达的SFTSV NP能够与RNA自组装形成不同聚集状态的复合物,并解析了其与单链RNA形成的五聚体复合物结构。五个NP亚基通过其N端结构域(N-arm)介导相互作用,组装成环状五聚体。RNA分子被固定在五聚体内部的沟槽中,所有碱基均朝向蛋白内部,呈封闭构象,表明RNA在封装状态下无法直接参与复制和转录。NP亚基含有一个保守的疏水性结合沟槽,可容纳四个核苷酸,并在亚基界面额外结合2至3个核苷酸,形成序列非依赖但高度稳定的结合模式。微复制子实验表明,突变NP上与RNA结合的关键氨基酸会显著抑制报告基因的表达,验证了复合物中鉴定的RNA结合氨基酸的功能重要性。
对同科154个病毒NP蛋白的保守性分析显示,其RNA结合沟槽高度保守,提示该科病毒NP可能采用类似的RNA结合机制,并具有作为广谱抗病毒靶点的潜力。在冷冻电镜密度中,可观察到一段未建模的密度将RNA的5′端和3′端连接起来,这段密度很可能对应RNA的未建模末端区域。如果这些末端序列相互互补,它们可能形成RNA双链结构。布尼亚病毒各基因组片段的5′端和3′端在同一病毒种内高度保守,并具有较强的互补性,可能形成“锅柄”(panhandle)状的双链茎结构,使病毒基因组片段形成环状。基于此,该研究提出了SFTSV RNP组装模型(图1)。SFTSV RNP可能通过RNA的“锅柄”结构及NP-NP相互作用形成环状构象。病毒RNA聚合酶通过识别该锅柄结构来启动RNA合成。在延伸过程中,靠近复制中心的NP暂时解离,使包裹的基因组RNA暴露出来,从而被RNA聚合酶识别。同时,NP通过其柔性的N-arm维持空间定位。当RNA聚合酶通过后,暂时脱离的基因组RNA会重新被NP包裹。
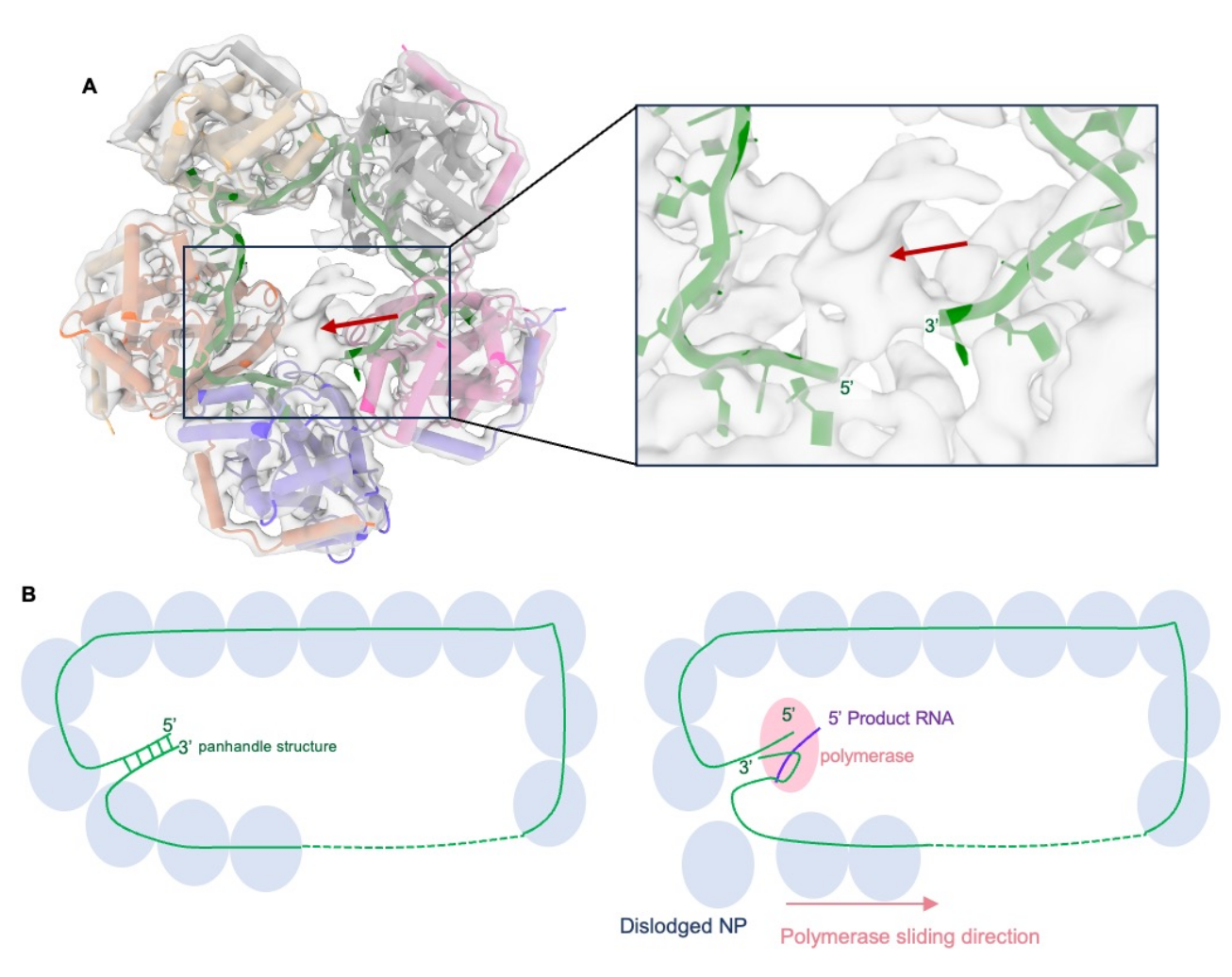
图1. SFTSV RNP示意图
总体而言,该研究揭示了SFTSV NP的RNA封装机制,为开发针对SFTSV及相关高致病性布尼亚病毒的广谱抗病毒药物提供了重要结构基础。该工作主要由武汉病毒所博士生王咏和硕士生吴昊完成,武汉病毒所邓增钦研究员和宁云佳研究员为文章通讯作者。该研究得到了国家重点研发计划和国家自然科学基金等项目资助,冷冻电镜数据收集得到了武汉病毒所冷冻电镜平台的支持。
 附件下载:
附件下载:
科学研究