蝙蝠作为第二大类哺乳动物,表现出许多独特的生物学特性,例如:蝙蝠是唯一能够持续飞行的哺乳动物;它是许多致命病毒的天然宿主,如埃博拉病毒,SARS冠状病毒,尼帕病毒等;蝙蝠寿命普遍很长,如4-8g体重的布氏鼠耳蝠(Myotis brandtii),寿命能达到40年。之前的研究显示:蝙蝠的DNA损伤修复通路存在大量正向选择的基因(Zhang et al, Science 2013);整个PYHIN基因家族(包括感应DNA的AIM2与IFI16)缺失可能导致炎症反应的削弱(Ahn et al, Sci Rep 2016) 等。这些研究提示:为了适应“飞行中加速代谢产生的氧化自由基(ROS)造成的DNA损伤”,蝙蝠在DNA损伤和DNA免疫通路中存在与其他哺乳动物不同的特性。
STING是多个DNA诱导的干扰素产生通路中一个关键分子。在该研究中,研究者们通过对30种蝙蝠的STING基因进行分析,发现其它哺乳动物中高度保守的磷酸化位点358Ser在所有的蝙蝠种类中均发生了突变。进一步的研究发现,这个位点的突变不影响TBK1的磷酸化,但会导致下游IRF3磷酸化的减少,进而弱化干扰素的激活效应。在单纯疱疹病毒HSV的感染实验中,该位点的突变会减弱蝙蝠对HSV的抗病毒反应,从而更有利于HSV的复制。S358回复突变后的STING则恢复了其干扰素诱导以及抗病毒的功能,揭示了在进化过程中蝙蝠的适应性突变,从而避免过度的DNA-干扰素通路激活带来的免疫损伤。
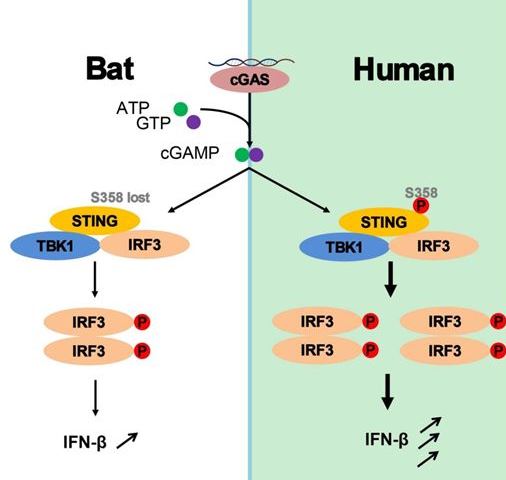
图一、蝙蝠STING基因S358位点突变导致干扰素激活减弱
该团队在2016年曾经在美国国家科学院院刊(PNAS)上以封面文章的形式报道了蝙蝠干扰素在进化过程中的适应性突变(Zhou et al, PNAS, 2016)。结果显示,相比如其他哺乳动物,蝙蝠的1型干扰素数量较少,但是仅有的三类干扰素alpha却处于组成性表达的状态,即处于“全天候防御”状态。本研究针对STING的发现更加证实了蝙蝠为了适应飞行而在进化中进行了适应性突变,从而直接或间接的影响了蝙蝠的天然免疫系统(专访,Yan et al, Nature Medicine 2015)。这种变化也许可以解释为何蝙蝠携带多种致死性病毒但是自身却不发病的原因(专著,Zhou et al, 2015, bat immunology in “Bat Immunology, in Bats and Viruses: A New Frontier of Emerging Infectious Diseases”)。这也被石正丽团队长达15年的持续跟踪调查所证实,该研究团队陆续报道了蝙蝠携带的如SARS样冠状病毒(Li et al, Science 2005; Ge et al, Nature 2013; Hu et al, PLoS Pathogens 2017); 腺病毒(Li et al, JVi 2010); 丝状病毒(Yang et al, EID 2017);呼肠孤病毒(Tan et al, JGV 2017)等。
中国科学院武汉病毒所的博士生谢家政为文章第一作者,周鹏青年研究员和石正丽研究员共同通讯作者。本研究获国家自然科学基金(创新团体31621061,面上项目81772199)、中国科学院先导科技专项(XDPB0301)、新加坡NRF2012NRF-CRP001–056等资助,研究也获得了武汉病毒所王延轶研究员、王汉中研究员和郑振华老师的大力支持。
 附件下载:
附件下载:
科学研究