近期,中国科学院武汉病毒研究所李朝阳研究员领导的科研团队在非糖基化朊病毒蛋白介导信号传导及功能研究方面取得重要进展。相关研究结果发表在国际学术期刊Cellular Signalling上。
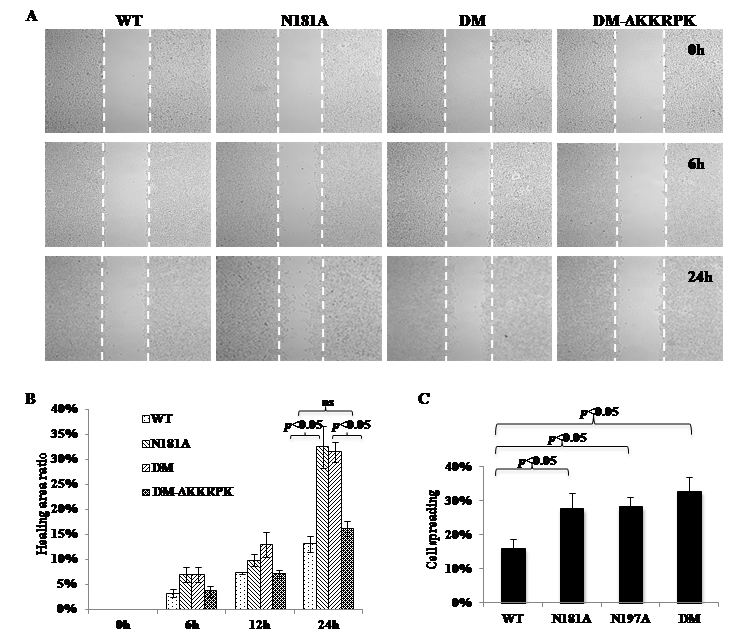
朊病毒感染引起的传染性海绵状脑病是一种致死性的神经退行性疾病。在生物体内朊蛋白是朊病毒感染的必须组分。朊蛋白(prion protein,PrP)是一种分布于细胞表面含有糖基磷脂酰肌醇锚(GPI-anchor)的糖蛋白,它有双糖基化,单糖基化和无糖基化三种形式。朊蛋白的具体生物学功能尚不确定。一般认为朊蛋白在细胞生长,细胞迁移,细胞凋亡等过程有重要作用。李朝阳研究团队通过对PrP上糖基位点的突变,获得了各种糖基缺陷的PrP。研究表明糖基不影响PrP分布于细胞表面,但糖基缺陷的PrP在细胞表面脂筏的定位明显增加;糖基缺陷型PrP能够与糖胺聚糖(GAG)和血管内皮生长因子受体2(VEGFR2)结合,激活并介导PI3K/Akt的信号通路;通过对GPI-anchor的突变表明GPI-anchor对于糖基缺陷的PrP功能表达非常重要,没有GPI-anchor的糖基缺陷型PrP不表达在脂筏中也不能激活VEGFR2信号。同时研究表明激活VEGFR2信号通路需要有GAG的参与,糖基缺陷的PrP缺失GAG结合域后信号传导被削弱,用GAG酶处理糖基缺陷的PrP后该信号也被下调。这些结果表明糖基缺陷PrP通过结合GAG和VEGFR2来促进细胞贴壁和细胞迁移。
本研究得到了中国科学院计划、国家自然科学基金以及湖北省自然科学基金等项目的资助。论文链接:http://www.sciencedirect.com/science/article/pii/S089865681630064X
 附件下载:
附件下载:
科学研究