众所周知,蛋白质是生命活动的物质基础。对蛋白质组装进行理性设计和控制不仅有助于加深对生命本质的认识,也可能产生新的性质和功能。随着科技的发展,人们已经能够以蛋白质亚基或多肽作为基础模块从头设计和构建人工蛋白质纳米结构。然而,由于蛋白纳米材料复杂的或对称的表面化学性质,如何使蛋白质纳米结构进行更高一阶的组装形成离散的结构,而不是无限的阵列或聚集体,仍然是一项巨大的挑战。最近,武汉病毒所李峰课题组与中科院苏州纳米技术与纳米仿生研究所王强斌研究员课题组合作,在他们前期建立的蛋白质纳米笼单功能化策略的基础上(J. Am. Chem. Soc. 2011, 133: 20040),发展了一种控制蛋白质纳米笼多层级组装形成离散纳米结构的简便策略(ACS Appl. Mater. Interface, 2015, 7: 11024)。
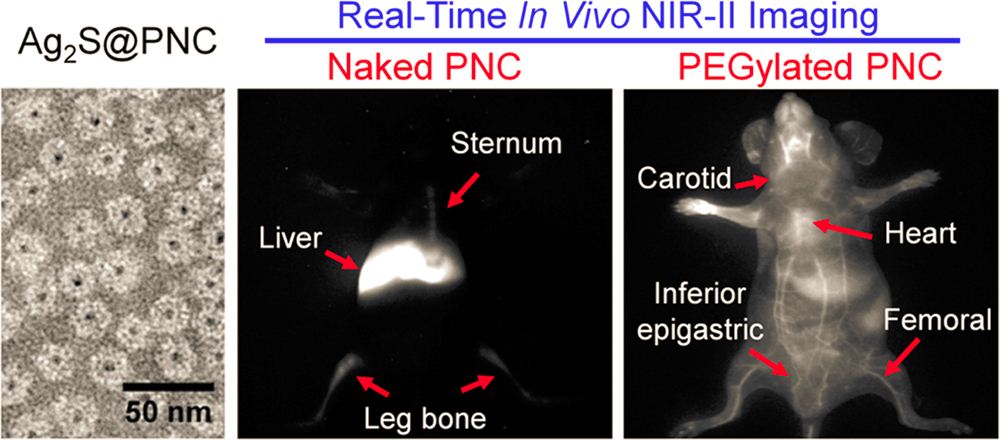
蛋白质纳米笼是颇具发展潜力的纳米生物医学创新平台。对蛋白笼的活体行为进行实时追踪可以为发展基于蛋白笼的诊断和治疗技术提供关键信息。近日,该合作团队以SV40病毒主要衣壳蛋白VP1形成的蛋白笼为模型,建立了一种通过在蛋白笼内部包装近红外二区荧光(NIR-II,1000-1700 nm)Ag2S量子点对其活体行为进行实时成像的策略。借助NIR-II荧光成像的高时空分辨和高组织穿透性,实现了SV40蛋白笼在小鼠活体内行为的高保真实时动态追踪,并通过聚乙二醇修饰,揭示了蛋白笼表面化学性质依赖的活体行为规律。这种包装量子点的标记方式有效避免了纳米探针对蛋白笼-活体相互作用的干扰。该成像策略为研究外源导入的蛋白笼材料与活体之间的相互作用规律提供了便捷途径,对发展新型疫苗、活体传感技术和靶向控释技术具有重要的促进作用。该工作一经ACS Nano在线发表(DOI: 10.1021/acsnano.5b05503),即被美国著名科技新闻周刊C&EN进行了报道。
论文链接:
http://pubs.acs.org/doi/abs/10.1021/acsami.5b02823
http://pubs.acs.org/doi/abs/10.1021/acsnano.5b05503?journalCode=ancac3
C&EN报道链接:
http://cen.chempics.org/post/133099749071/inner-glow-biomedical-researchers-are-looking-at#top
 附件下载:
附件下载:
科学研究